江苏省中药高效给药系统工程技术研究中心狄留庆教授、王若宁副教授团队围绕恶性肿瘤、中枢神经系统疾病等重大疾病的药物递送关键科学问题,致力于仿生型智能靶向系统的设计与应用研究,并与中药及其活性成分相结合,以期为中药新剂型与新技术的发展提供新思路。团队最近连续在国际知名学术期刊Bioactive Materials(IF:14.593,JCR 1区)、Acta Pharmaceutica Sinica B(IF:11.413,JCR 1区)、Journal of Controlled Release(IF:9.776,JCR 1区)和Journal of Nanobiotechnology(IF:10.435,JCR 1区)在线发表最新研究成果。
脑胶质瘤是最恶性的原发性肿瘤之一。由于血脑屏障(BBB)的存在、对化疗/放疗的耐性以及对正常脑组织不可避免的损伤,脑胶质瘤的治疗效果受到严重限制。受高密度脂蛋白(HDL)自然结构和特性的启发,该团队通过将tLyP-1与载脂蛋白A-I模拟肽(D4F)融合,构建了一种肿瘤穿透性脂蛋白,用于共递送光敏剂吲哚菁绿(ICG)和靶向HIF-1α的亲脂性小干扰RNA(siHIF),以“Lipoprotein-biomimetic nanostructure enables tumor-targeted penetration delivery for enhanced photo-gene therapy towards glioma”为题发表于Bioactive Materials上。所设计的脂蛋白仿生纳米粒可最大限度地发挥多种诊疗方式的协同作用,为精确肿瘤定位和胶质瘤的早期诊断、靶向、长效和联合治疗提供了有效的策略(Fig.1)。

Fig. 1. Schematic illustration of ptHDL/siHIF-ICG and site-specific release for augmenting the FI imaging-guided photo-gene therapy of glioma.
由于胶质瘤特殊的生理病理特点,大多数治疗药物难以进入大脑。为了改善现有疗法的不良预后,研究人员致力于开发非侵入性方法来克服胶质瘤治疗的障碍。纳米药物递送系统(NDDS)已广泛用于精准的药物递送。多种精心设计的NDDS在临床前研究中表现突出,包括级联跨越BBB并靶向胶质瘤病变部位、响应胶质瘤微环境的药物释放、基于内源性细胞/细胞外囊泡/蛋白质的仿生递送系统以及根据中药活性成分构建的载体。团队以“Gather wisdom to overcome barriers: Well-designed nano-drug delivery systems for treating gliomas”为题发表于Acta Pharmaceutica Sinica B上,讨论了目前正在进行和已完成的用于胶质瘤治疗临床试验的NDDS,总结了运用NDDS递送中药活性成分的研究(白藜芦醇、紫草素、薄荷醇、麝香酮、甘草酸、姜黄素、人参皂苷等),并分析了这些精心设计的NDDS临床转化所面临的挑战和趋势(Fig.2)。
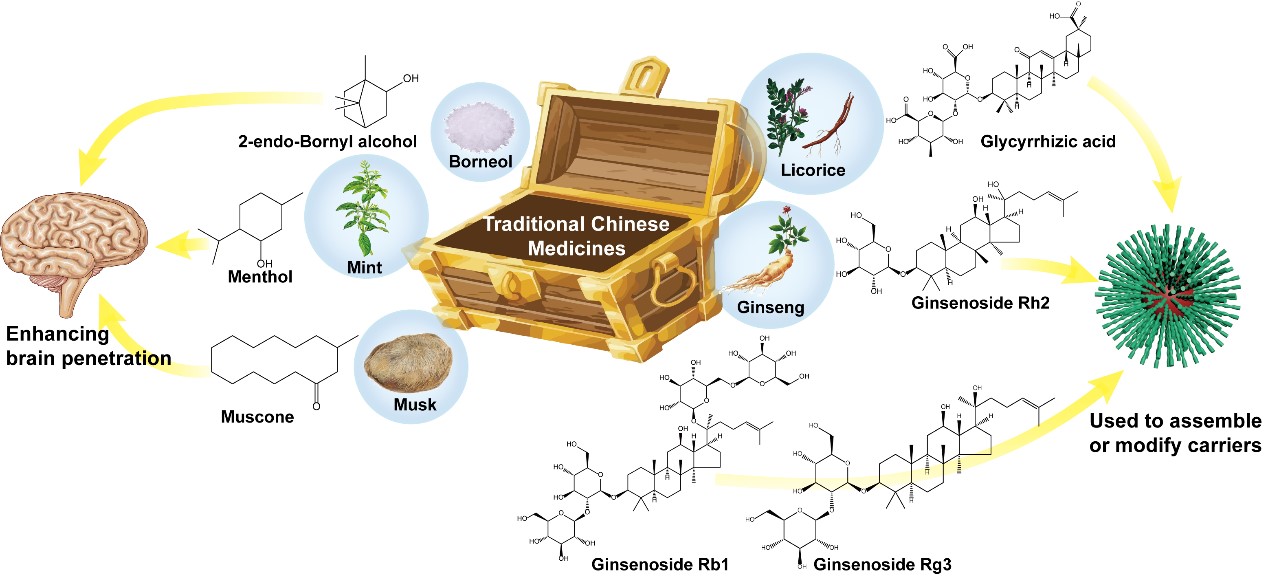
Fig2.The unique contribution of some active ingredients of TCM to brain drug delivery.
细胞外囊泡(EVs)是纳米级的天然衍生囊泡,包含多种反映其细胞来源的生物活性分子。这些携带特定信息的纳米囊泡具有天然的跨越BBB的能力和优异的生物相容性,被认为是脑疾病治疗和药物递送的智能载体主要候选者,为从生物标志物到治疗剂及递送载体的多种不同临床应用提供了新策略。团队以课题组研究方向出发,以“Emerging prospects of extracellular vesicles for brain disease theranostics”为题发表于Journal of Controlled Release上,概述了EVs的特性和用于EVs有效药物荷载及修饰的策略和方法。聚焦于EVs在脑疾病中的诊断治疗应用,分析了当前研究的挑战和障碍,并进一步讨论了EVs成功临床转化的前景(Fig.3)。
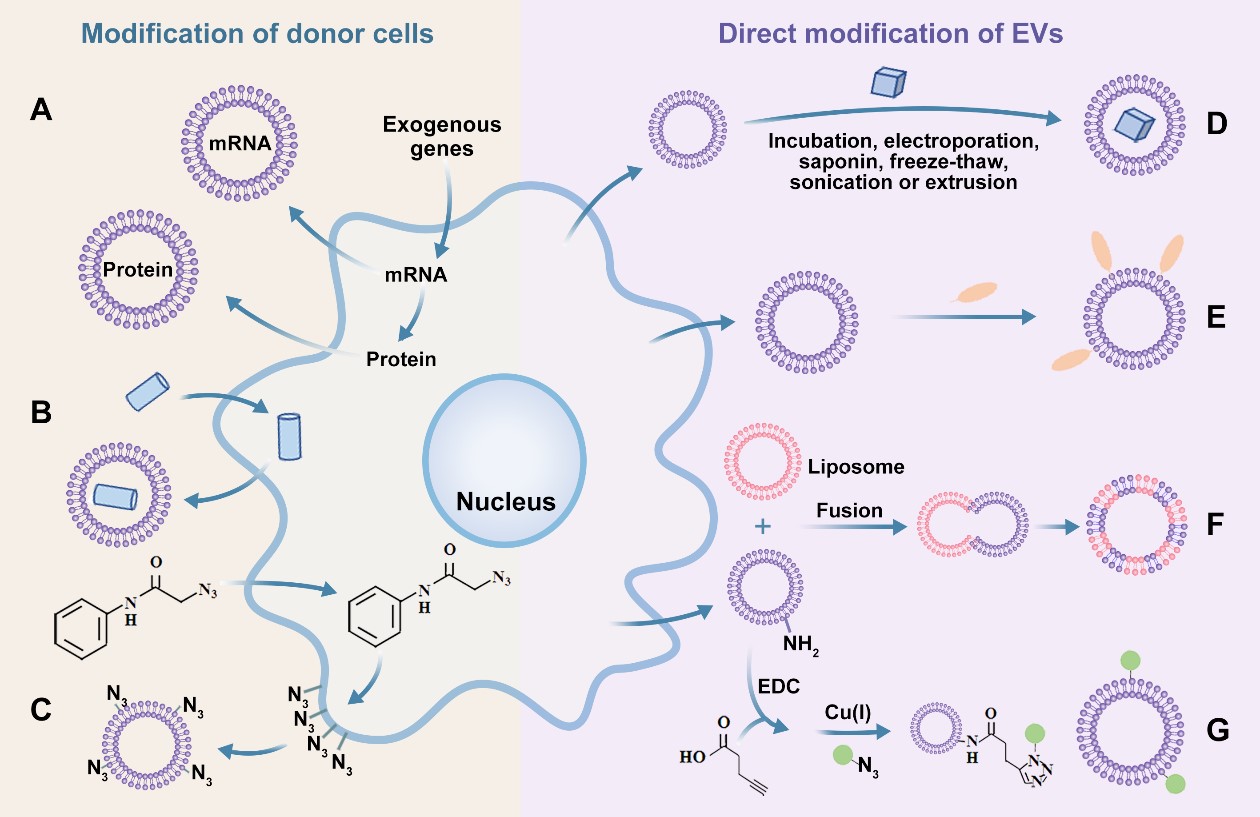
Fig.3 Strategies for EV engineering.
转移性癌症仍然是癌症治疗的主要挑战。完全由药物活性分子组成的无基质纳米分散体被认为是下一代新型药物制剂的候选者。这些纳米分散体由药物分子的自组装制成,能够安全有效地将治疗药物输送到局部病变部位。大黄酸(RHE)是源自中药大黄的生物活性分子,具有强大的抗炎和抗氧化活性。然而,由于RHE的疏水性,血管给药极其困难。团队开发一种通过RHE和阿霉素(DOX)分子自组装制备纳米制剂的绿色工艺,以“Synergistic inhibition of metastatic breast cancer by dual-chemotherapy with excipient-free rhein/DOX nanodispersions”为题发表于Journal of Nanobiotechnology上。该研究为通过自组装方法直接利用双亲性药物分子作为乳化剂分散疏水性药物、制备纳米制剂提供了参考,有助于推动基于中药活性成分的纳米制剂研究工作水平的提升,值得深入研究(Fig. 4)。

Fig.4 MD simulations of process for RHE and DOX molecules co-assemble in water.
上述研究获得国家自然科学基金(81903557、82074024)、江苏省自然科学基金(BK20190802)、江苏省高等学校自然科学基金(19KJB350003)、江苏省科协青年科技人才托举工程、南京中医药大学自然科学基金青年项目(NZY81903557)、南京中医药大学中药学一流学科开放课题(2020YLXK019)等项目的资助支持。
原文链接:
1. https://www.sciencedirect.com/science/article/pii/S2211383521003038#sec3.4
2. https://www.sciencedirect.com/science/article/pii/S0168365921006775?dgcid=author
3. https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-020-00679-2
4. https://www.sciencedirect.com/science/article/pii/S2452199X21005041